Seit der Isolation der ersten Taq DNA-Polymerase 1976 ist die PCR aus dem Molekularbiologie-Labor nicht mehr wegzudenken. Selbstverständlich haben sich die Methoden, die eingesetzten Reagenzien und die Protokolle stetig weiterentwickelt. Dabei ist das Ziel ganz klar: Es muss besser, schneller, günstiger und einfacher sein. Denn tagtäglich verbringen LabormitarbeiterInnen, Studierende und WissenschaftlerInnen weltweit unzählige Stunden mit Pipettieren und Vorbereiten der PCR-Experimente. Umso ärgerlicher ist es dann, wenn Fehler und Kontaminationen erst im letzten Schritt des PCR-Workflows sichtbar werden.
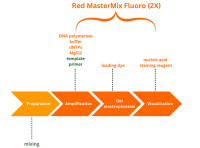
Doch wie kann die Laborarbeit im PCR-Labor optimiert werden, um letztlich Fehlerquellen zu minimieren und gleichzeitig Zeit, Kosten und Nerven einzusparen? Wir von Genaxxon wollen Licht ins Labor-Dunkel bringen und entlang eines typischen PCR-Workflows beleuchten, wie unsere neuen Produkte rund um den Red Mastermix Fluoro (2X) helfen, Ihren PCR-Workflow zu optimieren.
Doch wie kann die Laborarbeit im PCR-Labor optimiert werden, um letztlich Fehlerquellen zu minimieren und gleichzeitig Zeit, Kosten und Nerven einzusparen? Wir von Genaxxon wollen Licht ins Labor-Dunkel bringen und entlang eines typischen PCR-Workflows beleuchten, wie unsere neuen Produkte rund um den Red Mastermix Fluoro (2X) helfen, Ihren PCR-Workflow zu optimieren.
Die Standard-PCR-Amplifikation erforderte früher oft eine aufwendige DNA-Extraktion, Reinigung, Verarbeitung und Probenaufbereitung. Dabei wurden aus heutiger Sicht noch relativ primitive Geräte und komplexe Protokolle verwendet. Die Vorstellung, dass 35 PCR-Amplifikationszyklen in weniger als 25 Minuten abgeschlossen werden könnten, ohne die Genauigkeit und Zuverlässigkeit zu beeinträchtigen, wurde als Zukunftsvision angesehen.
Einer der häufigsten Anwendungsfehler in der PCR, Real Time PCR sowie RT-PCR besteht darin, dass ein fixes Protokoll für unterschiedliche Systeme mehrerer Anbieter verwendet wird. Die jeweilige Pufferzusammensetzung und vor allem der pH-Wert haben aber einen deutlichen Einfluss auf die jeweilige Annealingtemperatur.
Dabei bietet sich hierbei die Chance, Forschung und Diagnostik finanziell günstiger zu machen sowie sogar wesentlich zu vereinfachen, wenn sorgfältig individuell optimiert wird.
Dabei bietet sich hierbei die Chance, Forschung und Diagnostik finanziell günstiger zu machen sowie sogar wesentlich zu vereinfachen, wenn sorgfältig individuell optimiert wird.